I- Piles, batteries, quelles sont les différences d’un point de vue physique ?

A) Les piles : cas de la pile alcaline
1) Principe général :
Dans les métaux, le courant électrique est dû à un déplacement d’électrons.
Une pile est un générateur électrochimique qui crée du courant électrique. Elle convertit l’énergie chimique produite par une réaction d’oxydoréduction en énergie électrique (transférée au circuit extérieur) avec quelques pertes d’énergie sous forme thermique. Une réaction d’oxydoréduction est une réaction au cours de laquelle des électrons sont transférés entre les réactifs.
Une pile est constituée de deux compartiments (demi-piles) comportant chacun une électrode plongeant dans un milieu à caractère ionique (un électrolyte). Les deux électrodes assurent la jonction électrique avec le circuit extérieur. Ces deux compartiments sont reliés entre eux par un milieu conducteur à caractère ionique constituant une jonction électrolytique (permettant le transport des ions) appelée pont salin.
La surface des deux électrodes est le siège de transformations chimiques mettant en jeu un transfert d’électrons.
Une espèce chimique qui cède un ou des électrons est appelée un réducteur et une espèce chimique qui capte un ou des électrons est appelée oxydant. L’oxydant et le réducteur qui se transforment l’un en l’autre par gain ou perte d’électrons forment un couple oxydant/réducteur (noté Ox/Red). A tout couple Ox/Red est donc associée une demi-équation d’oxydoréduction : Ox + n e - = Red
- L’électrode dont la surface perd des électrons est le siège d’une transformation chimique appelée oxydation modélisée par une demi-équation pouvant s’écrire : Red1 ? Ox1 + n e - (une oxydation correspond à une perte d’un ou plusieurs électrons)
Cette électrode est appelée anode et constitue le pôle négatif de la pile (les électrons circulent du pôle – vers le pôle +)
- L’autre électrode dont la surface reçoit les électrons est le siège d’une transformation chimique appelée réduction modélisée par une demi-équation pouvant s’écrire : Ox2 + n e - ? Red2 (une réduction correspond à un gain d’un ou plusieurs électrons).
Cette électrode est appelée cathode et constitue le pôle positif de la pile.
Lors de ces transformations, des espèces chimiques (réactifs Red1 et Ox2) disparaissent et des espèces chimiques se forment (produits : Ox1 et Red2).
Le pont salin assure la neutralité électrique des solutions et assure la continuité électrique - le courant électrique circulant dans le circuit extérieur correspond au déplacement des électrons dans les électrodes et au déplacement des ions dans les solutions.
Le schéma ci-dessous explique le fonctionnement d’une pile cuivre/aluminium :
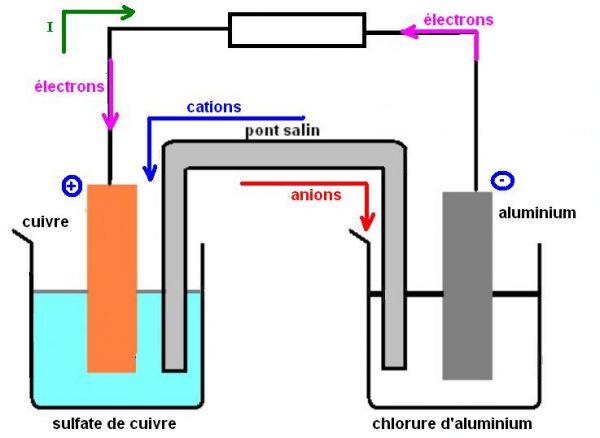
Ici, c’est une pile cuivre/aluminium les électrons migrent de l’électrode en aluminium (constituant ainsi l’anode) vers l’électrode en cuivre (constituant la cathode). Cela aura pour conséquence :
• Au niveau de l’anode, l’électrode en aluminium perd des électrons selon la demi-équation Al(s) ? Al3+ (aq)+ 3 e- ce qui correspond à une oxydation de l’aluminium Al(s). L’électrode en aluminium Al(s) est donc consommée et il se forme des cations (ions positifs) Al3+ (aq) qui vont se disperser dans la solution.
• Au niveau de la cathode, les électrons qui arrivent sont captés à sa surface par les ions Cu2+ contenus dans la solution de sulfate de cuivre (Cu2+(aq) + SO42-(aq)) selon la demi-équation Cu2+(aq)+2 e- ? Cu(s) ce qui correspond à une réduction des ions cuivre Cu2+(aq). Des ions cuivre II Cu2+(aq) sont donc consommés et du métal cuivre Cu(s) se forme.
A l’intérieur de la pile, le passage du courant électrique est dû à un double déplacement d’ions : les anions se déplacent dans le sens inverse du sens conventionnel du courant et les cations dans le sens du courant (les cations se déplacent dans la solution vers la cathode). Le pont salin permet le passage du courant électrique entre les deux compartiments de la pile en assurant le transfert des ions entre les deux électrolytes tout en assurant la neutralité électrique de ceux-ci.
.
Lors de son fonctionnement, la réaction chimique qui a lieu est une réaction dite d’oxydoréduction correspondant simultanément à l’oxydation de l’aluminium Al(s) et à la réduction des ions cuivre Cu2+(aq).
Cette réaction peut se modéliser par l’équation :
2Al(s) + 3Cu2+ (aq) => 3Cu(s) + 2Al3+ (aq)
Le transfert des électrons cédés par Al(s) et captés par Cu2+(aq) est indirect car les électrons passent par le circuit extérieur. Ce déplacement d’électrons correspond au courant débité par la pile.
2) La pile alcaline :
Il existe de nombreux types de piles différentes mais leur fonctionnement est similaire. Nous allons nous pencher ici sur le cas de la pile alcaline. Les caractéristiques de cette pile sont inscrites dans le tableau ci-dessous :
| Composant | Constituant | Formule chimique |
|---|---|---|
| Anode | Zinc | Zn |
| Cathode | Dioxyde de manganèse | MnO2 |
| Electrolyte | Hydroxyde de potassium | KOH |
Remarque : la pile Alcaline tient son nom du potassium contenu dans l’électrolyte qui est un métal alcalin.
Le schéma ci-dessous d’une pile (dite cylindrique due à sa forme) est peu différent du schéma classique précédent.
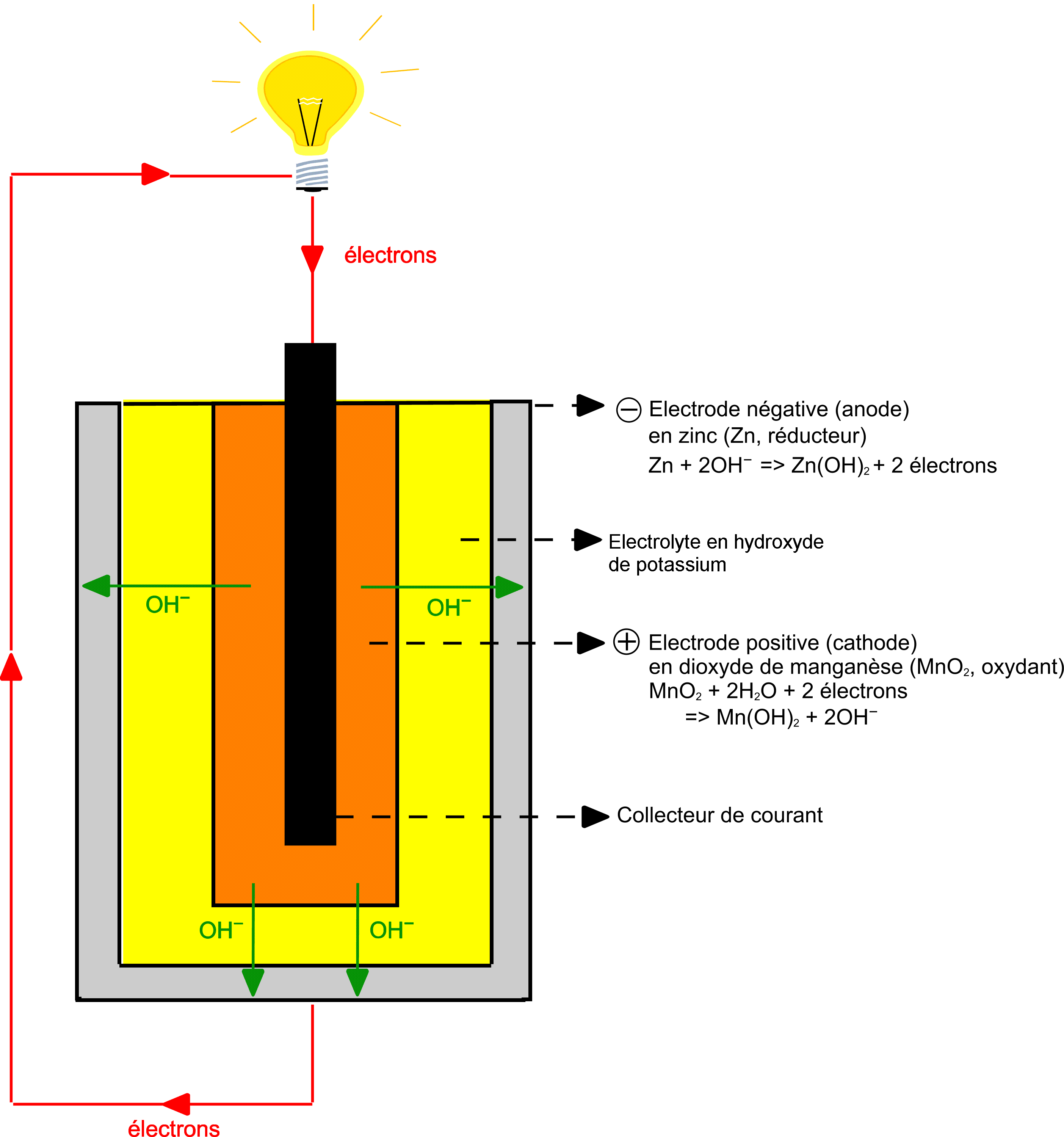
Au niveau de l’anode, lieu d’une oxydation nous avons le couple Zn(s)/ ZnO(s) qui réagit, l’équation de cette réaction s’écrit comme ceci :
Zn(s) + 2 OH-(aq) = ZnO(s) + H2O + 2 e-
Au niveau de la cathode c’est le couple MnO2(s)/MnO(OH)(s) qui réagit pour la réduction qui s’écrit :
MnO2(s) + H2O + e- = MnO(OH)(s) + HO-(aq)
L’équation finale d’oxydo-réduction s’écrit alors :
Zn(s) + 2 MnO2(s) + H2O = ZnO(s) + 2 MnO(OH)(s)
B) Les batteries : cas de la batterie au Lithium:
1) Constitution de la batterie au lithium :
L'anode est le plus souvent en graphite (C).
La cathode est constituée d'un métal oxydé tel que : le dioxyde de cobalt et de lithium (LiCoO2) ou le lithium phosphate de fer (LiFePO4)
L'électrolyte est un mélange d'ions lithium (comme l'hexafluorophosphate de lithium (LiPF6), le tetrafluoroborate de lithium (LiBF4) ou le perchlorate de lithium (LiClO4)) dans un solvant organique (comme le carbonate d'éthylène (C3H4O3) ou le carbonate de diéthyle (C5H10O3)).
2) Fonctionnement :
La batterie d’accumulateur (appelée couremment batterie ou accumulateur) a le même principe de fonctionnement que la pile électrique pour la décharge mais la différence est que la batterie peut-être rechargé (la charge utilise le principe de l’électrolyse).
Une électrolyse résulte de l’application d’une tension électrique entre deux électrodes plongeant dans une solution électrolytique ce qui provoque un transfert d'électrons entre un réducteur et un oxydant.
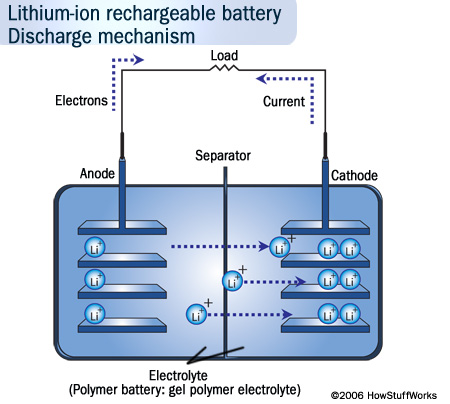
Sur le schéma ci-dessus, nous voyons, dans l’électrolyte, un déplacement des ions Li+ de l’anode (pôle -) vers la cathode (pôle +). Ceci est dû au fait que la cathode est le siège d’une réduction qui consomme des électrons provenant, par l’intermédiaire du circuit extérieur, de l’anode (siège d’une oxydation qui libère des électrons). En conséquence, la partie de droite va être chargée négativement donc les charges positives des ions Li+ sont attirées vers la cathode.
3) Rechargement :
Le rechargement d'une batterie est le résultat de l’électrolyse.
Pour cela, il est nécessaire de relier les deux pôles de la batterie à un générateur de tension continue de manière à ce que le sens de la réaction soit inversé par rapport à celle de l'oxydoréduction.
Ainsi l’équation chimique est inversée et permet de reformer les réactifs de l’oxydoréduction (consommés lors de la décharge) ce qui donne à la batterie un nouveau cycle de vie
(voir schéma et explications ci-dessous).
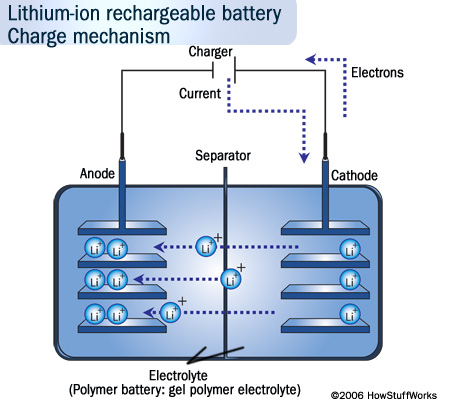
L’anode et la cathode de la batterie sont reliés à un générateur appelé chargeur. Ce dernier impose le sens du courant de manière à ce qu’il soit inversé par rapoort au sens naturel (sens de l’oxydoréduction).
Ainsi les électrons migrent vers l’anode et les ions Li+ traversent l’electrolyte pour équilibrer la réaction.
4) Durée de vie
Rien est éternel…Il faut tout d’abord savoir qu'un cycle correspond à un rechargement à 100 % de la capacité de la batterie.
Le fait qu’une batterie possède une durée de vie vient du fait qu’il y a formation d’une couche bloquant l’intercalation du lithium, de la dégradation des électrodes et de l’électrolyte. Moins de lithium peut bouger signifie logiquement moins de capacité. Il est néanmoins très difficile de déterminer à quel point l’accumulateur perd en capacité. Quelques tests ont tout de même été réalisées
(voir schéma ci-dessous).
Ainsi les électrons migrent vers l’anode et les ions Li+ traversent l’electrolyte pour équilibrer la réaction.
4) Durée de vie
Rien est éternel…Il faut tout d’abord savoir qu'un cycle correspond à un rechargement à 100 % de la capacité de la batterie.
Le fait qu’une batterie possède une durée de vie vient du fait qu’il y a formation d’une couche bloquant l’intercalation du lithium, de la dégradation des électrodes et de l’électrolyte. Moins de lithium peut bouger signifie logiquement moins de capacité. Il est néanmoins très difficile de déterminer à quel point l’accumulateur perd en capacité. Quelques tests ont tout de même été réalisées
(voir schéma ci-dessous).
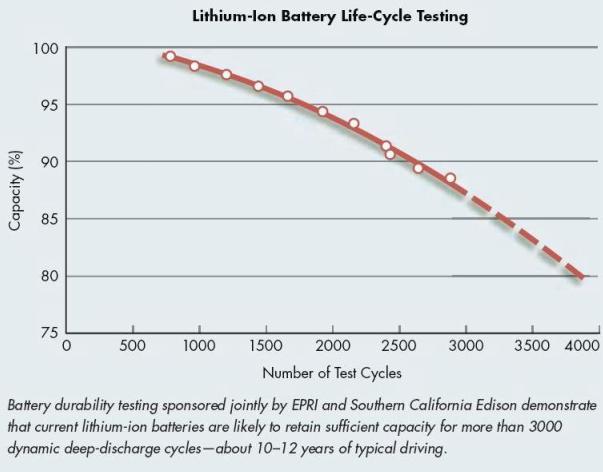
Sur ce schéma, on peut voir que la capacité de la batterie n’est pas toujours la même. En effet, avant utilisation (0 cycle) la capacité de la batterie est à son maximum (100%) mais petit à petit cette capacité diminue en fonction du nombre de cycles : au bout de 3 000 cycles, la batterie a perdu à peu près 12% de sa capacité initiale.
